
Diagnose einer Akuten Lymphatischen Leukämie
Vom Hausarzt überwiesen worden wegen dem Verdacht auf eine akute lymphatische Leukämie. Wie wird diese eigentlich diagnostiziert? Das klären wir in diesem Film mit Herrn Professor Aulitzky vom Robert-Bosch-Krankenhaus in Stuttgart.
Keine Lust zu lesen? Hier sind alternative Medien:
Sie sehen gerade einen Platzhalterinhalt von Standard. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf den Button unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Weitere InformationenDie erste Auffälligkeit ist meistens ein pathologisches Blutbild. Dieses wird mit bestimmten Verfahren analysiert, die Zusatzinformationen geben. Damit kann man meistens relativ präzise Diagnosen wie akute Leukämie, akute lymphatische oder akute myeloische Leukämie stellen. Der nächste Schritt ist eine Knochenmarksuntersuchung. Für diese sind die Vorergebnisse wichtig, weil man damit die tiefergehenden Untersuchungen aus dem Knochenmark weiter steuern kann.
Knochenmarkuntersuchung
Bei der Knochenmarkuntersuchung wird am Beckenkamm untersucht. Das hat mit dem Rückenmark nichts zu tun. Die Knochenmarkuntersuchung ist eine relativ wenig belastende Untersuchung, die man aus diesem Grund auch bei katastrophalen Blutwerten umgehend durchführen kann, da man sie in lokaler Betäubung durchführt. Eine Operation wäre zum Beispiel bei schlechten Blutwerten schwierig. Aus dem Knochenmark werden Knochenmarkbröckchen herausholt und einer Untersuchung zugänglich gemacht. Dort entsteht das Blut und dort ist auch die Ursache der Erkrankung. Deshalb muss man dort nachschauen. Hier sieht man erstens die Blutbildung bzw. ob die Blutbildung noch in Resten vorhanden ist und zweitens sieht man die Art der Leukämie. Drittens gewinnt man in diesen Bröckchen auch teilungsfähige Zellen, die z. B. die Untersuchung der Chromosomen möglich macht. Daher hat man mit der Knochenmarkuntersuchung praktisch alle Informationen über die Art der Erkrankung, die vorliegt.
Allgemeiner Gesundheitszustand
Bevor man weiter diagnostiziert, wird der allgemeine Gesundheitszustand untersucht. Die anstehenden Therapien sind sehr belastendend. Deshalb ist es wichtig zu wissen, wie fit ein Patient ist. Dazu gehört auch, dass man weiß, welche Organe Begleiterkrankungen haben und welche Organe Vorschäden haben, damit die Belastbarkeit dieses Menschen gut eingeschätzt werden kann. Daher gehört immer eine allgemeine internistische Untersuchung dazu, bei der man weiß, ob Herz und Leber gesund sind oder ob es Einschränkungen gibt, die man bei der Wahl der Medikamente berücksichtigen muss.
Ausbreitungsdiagnostik
Blut ist überall, das heißt eine Leukämie ist nicht durch eine Operation der Nasenspitze heilbar. Es handelt sich um eine Ausbreitung im ganzen Körper. Neben der Ausbreitung im Blutbild in den Organen gibt es in seltenen Fällen auch Ausbreitungen, die andere Maßnahmen notwendig machen. Dazu gehört zum Beispiel der Befall der Gehirnhäute, weil manche Medikamente nicht gut in den Nervensystemraum eindringen können. Dann muss man spezielle Medikamente wählen oder den Rückenmarksraum speziell behandeln. Andere Formen, die spezielle Maßnahmen benötigen, sind seltenen Varianten, bei denen irgendwo Knoten entstehen. Leukämien können also auch manchmal zu Knotenbildung neigen und das führt dazu, dass man zum Beispiel eine Region zusätzlich bestrahlen muss. Daher gehört trotz dieser allgemeinen Ausbreitung der Leukämien eine Ausbreitungsdiagnostik dazu, um ein präzises Gesamtbild der Erkrankung zu bekommen.
Lumbalpunktion
Die Lumbalpunktion ist die Rückenmarkspunktion, die viele Patienten mit der Knochenmarkspunktion verwechseln. Während bei der Knochenmarkspunktion im Beckenknochen etwas Knochenmark rausgezogen wird, wird beim Rückenmark in den Rückenmarkskanal punktiert. Das ist der Raum in der Wirbelsäule, wo die Flüssigkeit das Rückenmark umfließt. Diese Flüssigkeit wird gewonnen, um zu untersuchen, ob hier Leukämiezellen sind. Der Nervenstrang wird dabei nicht berührt oder verletzt. Die Punktion wird dort durchgeführt, wo kein Rückenmark mehr ist. Es ziehen noch Nerven durch, aber das Rückenmark hört weiter oben auf. Deshalb wählt man diesen Ort unten in der Lendenwirbelsäule. In seltenen Fällen muss man an der Halswirbelsäule punktieren, aber das ist ein sehr viel komplexerer Prozess. Deshalb macht man das fast nie. Eine Verletzung des Rückenmarks mit entsprechenden Querschnittslähmungen oder ähnlichem gibt es dabei nicht!

Detaillierte Diagnostik
Bei der Analyse der Zellen wird heutzutage tief ins Detail gegangen. Es wird eine sogenannte detaillierte Diagnostik durchgeführt. Welcher Zelltyp liegt vor? Die Zellen werden auf zwei Ebenen sehr präzise charakterisiert. Die Art der Zelle, die früher nur durch das mikroskopische Aussehen beurteilt wurde, wird heute festgelegt, indem Sets an Oberflächenproteinen bestimmt werden. Diese Oberflächenproteine sind spezifisch für bestimmte Zelltypen, und so kann sehr genau bestimmt werden, was z. B. eine lymphatische Zelle oder eine B-Zelle ist.
Das zweite wichtige Verfahren ist das genetische Verfahren. Die Genveränderungen im Vergleich zu normalen Zellen werden untersucht. In der Zwischenzeit erkennt man sehr genau, welche Genveränderungen für diese Erkrankung charakteristisch sind und auch welche Genveränderungen welchen Einfluss auf die Heilbarkeit der Erkrankung hat. Das heißt, die mikroskopische Einschätzung bestimmt den Reifegrad der Zellen. Während ein reifer Lymphozyt eine ganz kleine Zelle mit einem sehr dichten Kern ist, sind die Blastenzellen größer und man erkennt am Kern, dass die Ausreifung gestört ist. Ein Blast ist eine unreife Zelle. Gesunde Menschen haben auch Blasten im Knochenmark, aber sie dürfen eine bestimmte Häufigkeit nicht überschreiten. Sind mehr als 5% Blasten im Knochenmark, ist es nicht mehr normal. Sind mehr als 20% Blasten im Knochenmark, kann die Diagnose einer akuten Leukämie gestellt werden.
Sinnbildlich gesprochen (wie im Film „Blutbildung & Stammzellen“) wäre ein Blaster wie ein unreifer Teig, aus dem man zwar noch alles mögliche machen kann, aber aus dem noch nichts geworden ist. Dementsprechend fehl am Platze, wenn er dort ist, wo eigentlich ein fertiger Kuchen sein sollte. Alle Zellen in unserem Körper, die funktionieren, müssen ein Leben lang Stammzellen nachbilden. Dementsprechend ist es plausibel, dass es wenige Stammzellen gibt, die viele Töchter haben. Und wenn ein Weg der Entwicklung aus der Stammzelle in die Tochterzelle, die die Funktion übernimmt, stecken bleibt, gibt es plötzlich viel zu viel unreife Zellen, die akkumulieren und verhindern, dass reife Töchter gebildet werden. Und das ist dieser unreife Teig.
Oberflächenmoleküle
Unsere Zellen haben in der Außenstruktur viele Nachrichtenmoleküle, mit denen sie mit der Außenwelt kommunizieren können. Anhand der Oberflächenmoleküle können Zellen voneinander unterschieden werden. Da macht es Sinn, dass sich die Zellen nicht zu sehr ähneln, weil sie fundamental verschiedene Funktionen haben, was die Wechselwirkung mit anderen Organen und mit anderen Zellen betrifft. Und daher gibt es Oberflächenmoleküle, die für einen Zelltyp spezifisch sind und es gibt solche, die für eine Gruppe spezifisch sind. Weil man diese sehr gut kennt, kann man mithilfe dieser Oberflächenmoleküle sehr präzise Reifungsgrad und Art der Zelle unterscheiden.

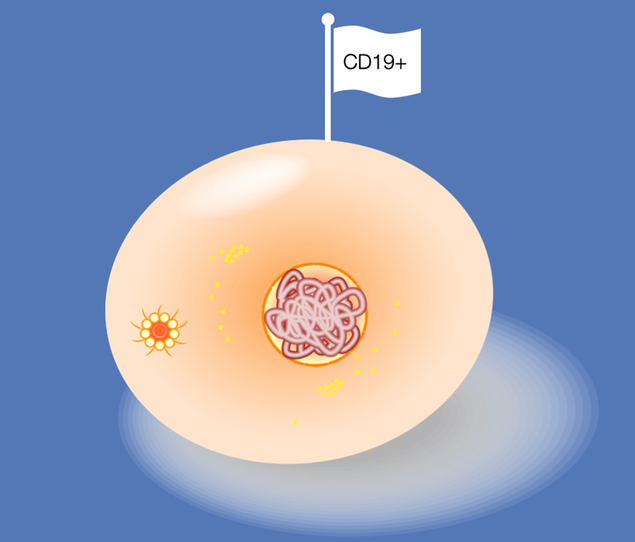
Welche speziellen und typischen Oberflächenmoleküle treten bei einer akuten lymphatischen Leukämie auf?
Die typischen haben Namen, die mit CD beginnen und mit einer Nummer enden. Es gibt aber auch andere Namen. CD heißt Cluster Designation (Beschreibung eines Proteinclusters). Die typischen für lymphatische Leukämien sind zum Beispiel CD19 als Marker für B-Zellen, CD3 als Marker für T-Zellen und CD34 als Marker für unreife Zellen. Diesen Immun Phänotyp finden die Patienten in den Befunden oder Arztbriefen beschrieben. Wenn man eine gute Konstellation hat, die auch die abnorme Lymphzelle präzise charakterisiert, kann man mit diesen Verfahren eine in 1.000 oder eine in 10.000 Zellen identifizieren.
Chromosomentranslokation
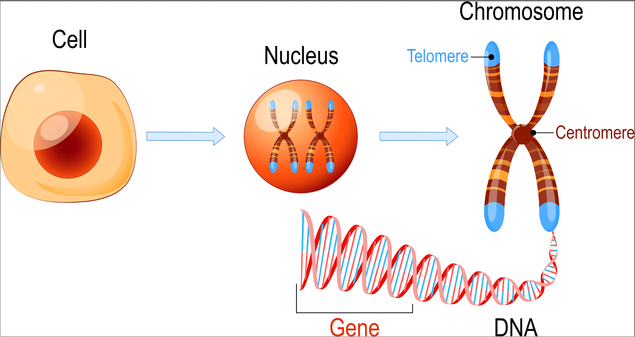
Schaut man noch detaillierter in die Zelle, sind dort die Chromosomen, auf denen die Informationen der Zelle gelagert sind. Auf den Genen passieren oftmals Fehler. Die Zelle vervielfältigt sich und es werden irgendwelche Schreibfehler gemacht. Man spricht hier von Chromosomentranslokation oder dass Dinge gelöscht oder dupliziert werden. Bei Chromosomenveränderungen und Veränderungen, die so klein sind, dass sie sich im Gesamtchromoson nicht zeigen würde, spricht man von Mutationen.
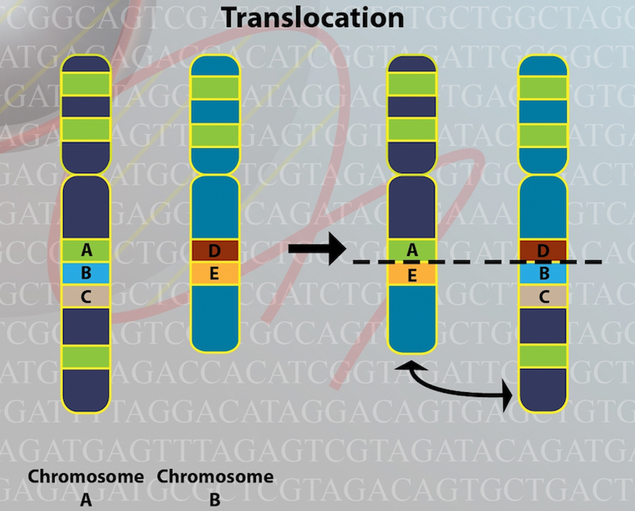
Chromosomale Veränderungen gibt es überall dort, wo sich Chromosomen falsch zusammenfügen. Fügen sich Anteile verschiedener Chromosomen falsch zusammen, nennt man das Translokationen.
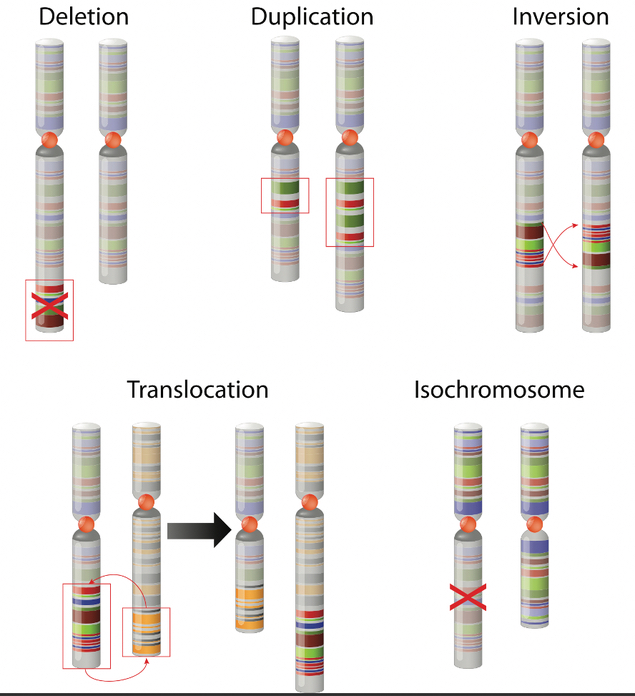
Es können Stücke verlorengehen oder gewonnen werden. Im Endeffekt führen diese Veränderungen immer dazu, dass Funktionen bestimmter Eiweißmoleküle nicht mehr vorhanden oder überschüssig vorhanden sind. Das ist der Schritt, der letztlich dazu führt, dass eine Zelle von einer gutartigen zu einer bösartigen wird.
Gibt es bei der akut lymphatischen Leukämie bestimmte Gendefekte, die besonders prägnant sind?
Es gibt keinen globalen ALL Marker. Es definieren sich aber bestimmte Subtypen über chromosomale Marker und einer dieser ist die erste Translocation, die überhaupt entdeckt worden ist: Das Philadelphia Chromosom. Dieses Chromosom hat man erkannt, weil ihm einfach ein Stück gefehlt hat. Und später hat man herausgefunden, dass sich zwei Abschnitte ausgetauscht haben. Das ist zum Beispiel eine Chromosomenveränderung, die eine sehr aggressive Variante einer Leukämie definiert und bei der man ernsthaft über Transplantation als zusätzliche Heilungsmaßnahme nachdenken muss.
Translokation noch einmal anschauliche erklärt: Chromosom 1 hat die Nachricht, die Ampel ist grün und deshalb darf ich fahren. Das Chromosom 2 hat die Nachricht, die Ampel ist rot und deshalb muss ich stehen. Wenn ich jetzt eine Translocation habe (wenn die Enden von diesen beiden Chromosomen vertauscht werden), dann kommt am Ende die Nachricht: Die Ampel ist grün und deshalb muss ich stoppen und die Ampel ist rot und deshalb darf ich fahren. Man sieht direkt, dass das gefährlich ist.
Die Gene sind chemische Buchstabenketten, die einen Sinn haben. Durch diese Translokationen wird der Sinn oder die Funktion dieses Proteins alteriert. Es können Wachstumssignale, die normalerweise reguliert stattfinden, plötzlich völlig irregulär aktiv bleiben und auf die Art und Weise das Wachstum der Zellen endlos stimulieren. Auch das Gegenteil gibt es: Signale können gestört sein, die normalerweise dazu beitragen, dass sich die Zelle zu ihrer Endzelle entwickelt, und deshalb bleibt sie stecken. Exakt solche Veränderungen werden durch die Translokationen verursacht.
HLA
Im Rahmen der Diagnose akuter Leukämien gibt es noch eine weitere Untersuchung, die eventuell notwendig ist. Das ist die HLA Typisierung. HLA heißt „Human leucocyte antigen“. Das sind Gewebsverträglichkeitsmerkmale. Merkmale, die bestimmen, ob ein Transplantat zusammenpasst oder nicht.
Diese Bestimmung ist essenziell bei zwei Gruppen von Menschen. Bei all denen, wo eine Transplantation in Frage kommt, weil man mit dieser Information nach einem Spender suchen kann. Zum zweiten entwickeln manche Patienten viele Antikörper gegen fremde HLA Moleküle. Das sind ganz typisch Mütter von Kindern, weil sie gegen das fremde HLA ihres Kindes Antikörper produzieren. Und diese kann man schwer mit Thrombozyten ersetzen. Auch hierfür braucht man die HLA Typisierung, um passende Thrombozyten-Präparate zu bekommen.
Was gibt es generell für Risikofaktoren bzw. Risikogruppen?
Die meisten der Risikofaktoren, die wir heute für die Steuerung der Therapie benutzen, sind genetische Risikofaktoren. Genveränderungen, von denen wir aus Erfahrung wissen, dass sich die Erkrankungen mit konventioneller Therapie nicht gut heilen lassen. Daneben ist die Qualität des Ansprechens ein Risikofaktor. Bei der akuten lymphatischen Leukämie stehen Verfahren zur Verfügung, die eine Zelle in einer Millionen Zellen nachweisen kann. Und diese Tiefe der Remission ist eine der wichtigen Voraussetzungen, sich darauf verlassen zu können, dass man auf dem Weg Richtung Heilung ist. Diese Verfahren sind bei den Lymphzellen so gut machbar, weil jede Lymphzelle in ihrem Antikörpergen einen individuellen Marker hat. Und damit kann man für jeden Patienten quasi eine spezifische Nachweisprobe generieren, mit dem man für ihn diese Zellen mit dieser hohen Präzision nachweisen kann.
Werden die Patienten heutzutage noch in Standard, Risiko und Hochrisiko einteilt?
Das wird nach wie vor gemacht, aber im Wesentlichen geht es um die Frage: Muss man oder kann man transplantieren. Kann man transplantieren heißt Alterung Komorbidität. Muss man transplantieren, heißt Genetik der Erkrankung.
Das bedeutet, dass man als Patient eigentlich nichts machen kann, um das Risiko zu vermindern?
Die Kriterien, die wir für die Krankheitseinstufung verwenden, sind unveränderliche Eigenschaften der Erkrankung. Insofern kann der Patient nicht das Risiko nicht minimieren. Bezüglich Begleiterkrankungen gibt es manche Dinge, die man beeinflussen kann, z. B. Rauchen aufhören während einer Chemotherapie ist prinzipiell immer eine gute Idee.

